
敬畏生命,为爱发声
医疗无国界,健康伴您行

免费咨询电话
400 - 001 - 2811

在线人工客服
09:00 ~ 23:00

敬畏生命,为爱发声
医疗无国界,健康伴您行

免费咨询电话
400 - 001 - 2811

在线人工客服
09:00 ~ 23:00

别称沃拉西地尼、vorasidenib
适应症沃拉西德尼适用于经手术(包括活检、次全切除或全切除)后确诊的具有易感IDH1或IDH2突变的Ⅱ级星形胶质细胞瘤或少突胶质细胞瘤的成人及12岁及以上儿童患者。
沃拉西德尼适用于治疗12岁及以上的成年和儿童患者,这些患者经美国食品药品监督管理局(FDA)批准的检测方法检测出携带异柠檬酸脱氢酶-1(IDH1)或异柠檬酸脱氢酶-2(IDH2)敏感突变,且在包括活检、次全切除或大体全切除的手术后,患有2级星形细胞瘤或少突胶质细胞瘤。
在开始使用沃拉西德尼之前,需评估血液生化指标和肝脏实验室检测指标。
根据肿瘤标本中是否存在IDH1或IDH2突变,选择患有2级星形细胞瘤或少突胶质细胞瘤的患者使用沃拉西德尼进行治疗。
推荐剂量:成年患者使用沃拉西德尼的推荐剂量为每日口服1次,每次40毫克,直至疾病进展或出现无法耐受的毒性。
12岁及以上儿科患者使用沃拉西德尼的推荐剂量根据体重确定:体重≥40千克的患者,每日口服1次,每次40毫克;体重<40千克的患者,每日口服1次,每次20毫克。持续使用沃拉西德尼进行治疗,直至疾病进展或出现无法耐受的毒性。
给药方式:用温水整片吞服沃拉西德尼片剂,可与食物同服或空腹服用。请勿掰开、压碎或咀嚼药片。
漏服剂量:每天尽量在同一时间服用沃拉西德尼片剂。如果漏服,应在6小时内尽快补服。如果漏服时间超过6小时,则跳过漏服的剂量,按预定时间服用下一剂。
呕吐:如果服药后发生呕吐,无需补服,次日按预定时间服用下一剂。
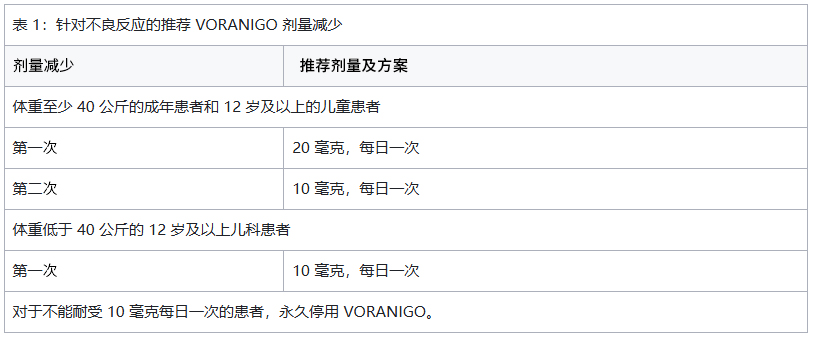
针对不良反应的沃拉西德尼推荐减量方案见表1
最常见的(≥15%)不良反应包括疲劳、头痛、COVID-19、肌肉骨骼疼痛、腹泻、恶心和癫痫发作。
3级或4级(≥2%)实验室异常为ALT升高、AST升高、GGT升高和中性粒细胞减少。
尚不明确
沃拉西德尼可导致肝转氨酶升高,进而可能引发肝衰竭、肝坏死和自身免疫性肝炎。
在汇总的安全性人群中,接受沃拉西德尼治疗的患者中,58%出现丙氨酸氨基转移酶(ALT)升高,44%出现天冬氨酸氨基转移酶(AST)升高。3级或4级ALT或AST升高的患者分别占9%和4.8%。在这些患者中,4.1%(10/244)同时出现3-4级ALT或AST升高。接受沃拉西德尼治疗的患者中,共有34%出现γ-谷氨酰转移酶(GGT)升高,其中2.2%为3级或4级。接受沃拉西德尼治疗的患者中,4.8%出现胆红素升高,0.4%为3级或4级。接受沃拉西德尼治疗的患者中,9%出现碱性磷酸酶升高,0.9%为3级或4级。
在开始使用沃拉西德尼之前,监测肝脏实验室检查指标(AST、ALT、GGT、总胆红素和碱性磷酸酶),在治疗的前2个月每2周监测一次,之后在治疗的前2年每月监测一次,并根据临床指征进行监测,对于转氨酶升高的患者应更频繁地检测。根据严重程度降低剂量、暂停用药或永久停用沃拉西德尼。
基于动物研究结果,孕妇服用沃拉西德尼可能会对胎儿造成伤害。在动物胚胎-胎儿发育研究中,在器官形成期给怀孕大鼠口服沃拉西德尼,当剂量达到基于最高推荐剂量下浓度-时间曲线下面积(AUC)的人体暴露量的45倍及以上时,会导致胚胎-胎儿毒性。在器官形成期给怀孕兔子口服沃拉西德尼,当剂量达到基于最高推荐剂量下AUC的人体暴露量的8倍及以上时,会导致胚胎-胎儿毒性。
告知孕妇和有生殖潜力的女性胎儿面临的潜在风险。建议有生殖潜力的女性在使用沃拉西德尼治疗期间及最后一剂用药后3个月内采用有效的非激素避孕措施,因为沃拉西德尼可能会使某些激素避孕药失效。建议有生殖潜力女性伴侣的男性患者在使用沃拉西德尼治疗期间及最后一剂用药后3个月内采用有效的避孕措施。
基于动物研究结果及其作用机制,孕妇服用沃拉西德尼可能会对胎儿造成伤害。目前尚无孕妇使用沃拉西德尼的数据,无法确定与药物相关的风险。在动物胚胎-胎儿发育研究中,在器官形成期给怀孕大鼠和兔子口服沃拉西德尼,当剂量达到基于最高推荐剂量下浓度-时间曲线下面积(AUC)的人体暴露量的8倍及以上时,会导致胚胎-胎儿毒性。告知孕妇胎儿面临的潜在风险。
目前尚无关于沃拉西德尼及其代谢物是否存在于人乳中、对母乳喂养婴儿的影响或对乳汁分泌影响的数据。由于沃拉西德尼可能会对母乳喂养的婴儿产生不良反应,建议女性在使用沃拉西德尼治疗期间及最后一剂用药后2个月内不要进行母乳喂养。
基于动物胚胎-胎儿毒性研究,孕妇服用沃拉西德尼可能会对胎儿造成伤害。
妊娠检测:在开始使用沃拉西德尼之前,确认有生殖潜力女性的妊娠状态。
避孕:建议有生殖潜力的女性在使用沃拉西德尼治疗期间及最后一剂用药后3个月内采用有效的非激素避孕措施。沃拉西德尼可能会使某些激素避孕药失效。建议有生殖潜力女性伴侣的男性患者在使用沃拉西德尼治疗期间及最后一剂用药后3个月内采用有效的避孕措施。
不育:基于动物研究结果,沃拉西德尼可能会损害有生殖潜力的女性和男性的生育能力。在大鼠实验中,对雌性和雄性生育能力的影响不可逆。
沃拉西德尼用于治疗12岁及以上患有2级IDH1或IDH2突变的星形细胞瘤或少突胶质细胞瘤的安全性和有效性已得到证实。预计12岁及以上儿科患者中沃拉西德尼的暴露量在推荐剂量下成人的暴露量范围内。沃拉西德尼用于12岁以下儿科患者任何适应症的安全性和有效性均未确立。
在INDIGO试验中,随机接受每日一次40mg沃拉西德尼治疗的167名患者中,1.2%(2名患者)年龄在65岁及以上。沃拉西德尼的临床研究未纳入足够数量的65岁及以上患者,无法确定他们与年轻受试者的反应是否存在差异。
肌酐清除率(CLcr)>40mL/min的患者,不建议调整剂量。
对于CLcr≤40mL/min或需要透析的肾功能损害患者,尚未对沃拉西德尼的药代动力学和安全性进行研究。对于CLcr≤40mL/min或需要透析的患者,应监测是否出现更多不良反应,并根据建议针对不良反应调整剂量。
轻度或中度(Child-PughA级或B级)肝功能损害患者,不建议调整剂量。
尚未对重度肝功能损害(Child-PughC级)患者中沃拉西德尼的药代动力学和安全性进行研究。对于重度肝功能损害患者,应监测是否出现更多不良反应,并根据建议针对不良反应调整剂量。
尚不明确
每日一次单剂量或多剂量给药后,在10至200毫克(为最高批准推荐剂量暴露量的0.2至4倍)的剂量范围内,沃拉西德尼的血浆最大浓度(Cmax)和药时曲线下面积(AUC)大致成比例增加。在最高批准推荐剂量下,稳态时的平均(变异系数%)Cmax为133纳克/毫升(73%),AUC为1988小时・纳克/毫升(95%)。每日一次给药28天内可达到稳态,AUC的平均蓄积比为4.4。
吸收
稳态时达到血浆最大浓度(tmax)的中位时间(最小值,最大值)为2小时(0.5至4小时)。
沃拉西德尼的平均绝对生物利用度为34%。
食物的影响
与空腹状态相比,高脂高热量(总计800-1000卡路里,其中500-600卡路里来自脂肪)的膳食使沃拉西德尼的Cmax增加3.1倍,AUC增加1.4倍。
与空腹状态相比,低脂低热量(总计400-500卡路里,其中100-125卡路里来自脂肪)的膳食使沃拉西德尼的Cmax增加2.3倍,AUC增加1.4倍。
分布
沃拉西德尼稳态时的平均(变异系数%)分布容积为3930升(40%)。
在体外,沃拉西德尼在人血浆中的蛋白结合率为97%,且不受其自身浓度影响。
脑肿瘤与血浆的浓度比为1.6。
消除
稳态时的平均(变异系数%)终末半衰期为10天(57%),口服清除率为14升/小时(56%)。
代谢
沃拉西德尼主要经CYP1A2代谢,CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6和CYP3A也有少量参与。非CYP代谢途径对其代谢的贡献可达30%。
排泄
单次口服放射性标记的沃拉西德尼后,85%的剂量经粪便排出(56%为原形药物),4.5%经尿液排出。
本网站不销售任何药品,只做药品信息资讯展示 鲁ICP备2023035557号-5 证书编号:(鲁)-经营性-2022-0196 找药网 找药助手