
敬畏生命,为爱发声
医疗无国界,健康伴您行

免费咨询电话
400 - 001 - 2811

在线人工客服
09:00 ~ 23:00

敬畏生命,为爱发声
医疗无国界,健康伴您行

免费咨询电话
400 - 001 - 2811

在线人工客服
09:00 ~ 23:00
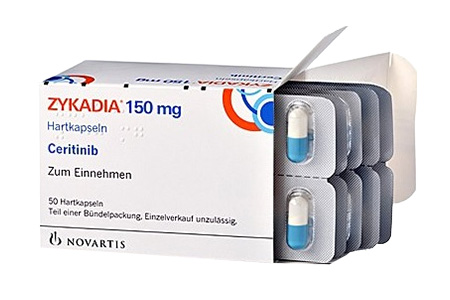

别称赞可达、色瑞替尼、赛立替尼、Ceritinib、LDK378、spexib
适应症用于治疗经美国食品和药物管理局(FDA)批准的试验检测为间变性淋巴激酶(ALK)阳性的转移性非小细胞肺癌的成年患者。
本品适用于此前接受过克唑替尼治疗后进展的,或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者。
胶囊剂:150mg/粒,50粒/盒。
本品为胶囊剂,内容物为白色至类白色粉末。
本品必须在有使用经验的医疗机构中并在特定的专业技术人员指导下使用。服用本品前,必须通过准确及经充分验证的检测方法进行ALK突变检测,确认为ALK阳性的NSCLC患者方可接受本品治疗。
本品的推荐剂量为每日一次,每次450mg,每天在同一时间口服给药,药物应与食物同时服用。只要观察到临床获益,应持续治疗直至疾病进展或出现不可耐受的毒性。如果忘记服药,且距下次服药时间间隔12小时以上时,患者应补服漏服的剂量。若治疗期间发生呕吐,患者不应服用额外剂量,但应继续服用下次计划剂量。
根据患者个体的安全性或耐受性情况,在治疗过程中可能需要暂时中断使用本品或下调剂量。如果下调剂量是因未列于说明书的药物不良反应所致,则应以150mg的下调幅度逐渐减少本品的日剂量。应注意早期识别药物不良反应并及早给予标准的支持性治疗措施。对于无法耐受每日随餐服用150mg剂量的患者,应停用本品。
本品治疗期间应避免联合使用强效CYP3A抑制剂。如果必须同时使用强效CYP3A抑制剂,则应将塞瑞替尼的剂量减少约三分之一,取整至最接近的150mg整数倍剂量。应密切监测患者的安全情况。当停止给予强效CYP3A抑制剂后,恢复使用强效CYP3A抑制剂之前塞瑞替尼的用药剂量。
空腹条件下接受本品750mg治疗的患者中,95%的患者发生了腹泻、恶心、呕吐或腹痛,其中14%的患者为重度病例(3级或4级)。36%的患者由于胃肠道不良反应需要中断给药或者下调剂量,1.6%的患者停止治疗。与食物同服本品450mg时,胃肠道不良反应的发生率和严重程度显著降低。
接受本品治疗的患者中,28%的患者发生了丙氨酸氨基转移酶(ALT)升高>5倍正常值上限(ULN),16%的患者发生了天门冬氨酸氨基转移酶(AST)升高>5倍ULN。约1.0%的患者由于肝毒性需要永久停药。
接受本品治疗的患者中,2.1%报告了ILD/非感染性肺炎,其中1.3%为3或4级,0.2%为致死性事件。
接受本品治疗的患者中,6%的患者在基线后ECG评估时出现了至少1次的较基线大于60毫秒的QTc间期延长。约1.3%的患者QTc间期大于500毫秒。
接受本品治疗的患者中,13%的患者出现了3或4级高血糖。患糖尿病和/或同时使用糖皮质激素的患者高血糖风险较高。
接受本品治疗的患者中,1%出现新发窦性心动过缓,1%报告心动过缓的药物不良反应。
接受本品治疗的患者中,不到1%报告胰腺炎,7%的患者出现3~4级淀粉酶升高,14%的患者出现3~4级脂肪酶升高。
老年人群:年龄≥65岁患者的安全性特征与年龄小于65岁的患者相似。
中国人群:在中国开展的研究中,观察到的药物相关不良反应与塞瑞替尼其他研究中的结果相似。
空腹服用本品时胃肠道毒性较为常见,与食物同服可降低其发生率和严重程度。
根据临床指征,给予患者标准监测及管理,包括止泻、止吐及补液治疗。必要时暂停给药并下调剂量。
治疗前及治疗期间应定期监测肝功能,包括ALT、AST和总胆红素。
出现肝功能异常时,应根据严重程度暂停给药并下调剂量或永久终止治疗。
监测患者出现的肺部症状,如呼吸困难、咳嗽和低热。
一旦诊断为治疗相关的ILD/非感染性肺炎,患者应永久终止本品。
先天性长QT综合征患者应避免使用本品。
充血性心力衰竭、心动过缓、电解质异常或正在使用已知可延长QT间期的药物的患者,应定期监测心电图(ECG)及电解质。
出现QTc间期延长伴心律失常的患者需暂停或永久终止本品。
治疗开始前及治疗期间应定期监测空腹血糖。
根据指征开始使用或优化降糖药物治疗。必要时暂停本品并下调剂量。
应避免与其他已知可致心动过缓的药物联用。
定期监测心率及血压。出现心动过缓时,应暂停本品并调整剂量。
治疗开始前及治疗期间应定期监测脂肪酶和淀粉酶。
出现胰腺炎时,应暂停使用本品并下调剂量。
本品对驾驶及机器操作的影响轻微,但患者在治疗期间应谨慎驾驶或操作机器,避免出现疲劳或视觉障碍。
育龄期女性:育龄期女性在服用本品期间直至终止治疗后6个月应采取高度有效的避孕措施。
妊娠:孕妇使用本品的数据有限,可能对胎儿造成伤害。应在妊娠期避免使用本品。
哺乳:尚不清楚人乳汁中是否存在塞瑞替尼或其代谢物。由于潜在的严重不良反应,应充分考虑哺乳对孩子的益处和本品治疗对女性患者的益处,决定是否停止哺乳或停止本品治疗。
生育力:未针对塞瑞替尼对生育力的潜在影响进行正式的临床前研究。本品导致男性和女性不孕的潜在风险尚不清楚。
尚未确认18岁以下儿童和青少年使用本品的安全性和有效性。目前无相关数据。
基于目前有限的相关安全性和有效性数据,65岁及以上的患者使用本品无需进行剂量调整。无85岁及以上患者的相关用药数据。
对塞瑞替尼或其辅料过敏者禁用。
先天性长QT综合征患者禁用(除非绝对必要)。
强效CYP3A抑制剂:与本品联合使用时,可显著升高本品的血药浓度。应避免同时使用强效CYP3A抑制剂。如果必须同时使用,应将本品的剂量减少约三分之一,并在停止使用CYP3A抑制剂后恢复原剂量。
P-gp抑制剂:可能增加本品的血药浓度。联合使用时应谨慎,并监测不良反应。
强效CYP3A和P-gp诱导剂:与本品联合使用时,可显著降低本品的血药浓度。应避免同时使用强效CYP3A诱导剂。
影响胃pH值的药物:质子泵抑制剂、H2受体拮抗剂等可能降低本品的生物利用度。应避免与这些药物同时使用。
CYP3A和CYP2C9底物:本品可能抑制这些酶的活性,增加其底物的血药浓度。应避免与窄治疗指数的CYP3A或CYP2C9底物同时使用。
CYP2A6和CYP2E1底物:本品可能抑制这些酶的活性,增加其底物的血药浓度。联合使用时应谨慎,并监测可能发生的不良反应。
存在或可能出现QT间期延长风险的患者应谨慎使用本品,包括服用抗心律失常药物或其他可能导致QT间期延长的药物。联合使用这些药物时需监测QT间期。
本品应与食物同服,以增加其生物利用度。
应避免进食葡萄柚和葡萄柚汁,因为这些食物可抑制肠壁CYP3A,增加本品的生物利用度。
尚未明确。若发生药物过量,应立即停药,并根据患者的具体症状进行对症支持治疗。必要时进行洗胃、活性炭吸附等措施,同时密切监测生命体征和重要器官功能。
遮光、密封、在干燥处保存。贮存温度不得高于25℃,避免将药物暴露在极端高温或低温环境中。选择干燥、通风良好的地方存放,防止药物受潮。定期检查药物包装的完整性,如有损坏应立即联系医生或药剂师。
24个月。
患者单次口服塞瑞替尼后,药物约在4至6小时内达到血浆峰浓度(Cmax)。其在体内的吸收、分布、代谢和排泄过程符合药物动力学的一般规律,但具体参数尚不明确。
塞瑞替尼是一种针对非小细胞肺癌(NSCLC)的靶向治疗药物,尤其适用于此前接受过克唑替尼治疗后进展或不耐受的间变性淋巴瘤激酶(ALK)阳性的患者。本文将详细介绍该药的相关信息,包括···【详情】
文章来源:找药网发布时间:2025-05-07 13:58:48推荐指数:1292
塞瑞替尼(Zykadia)作为ALK阳性非小细胞肺癌的靶向治疗药物,其副作用谱系涵盖多个系统···【详情】
推荐指数:12382025-08-28
色瑞替尼(Ceritinib)作为ALK阳性非小细胞肺癌的重要治疗药物,其严重副作用涉及多系···【详情】
推荐指数:12392025-08-28
塞瑞替尼(Ceritinib)作为治疗ALK阳性非小细胞肺癌的靶向药物,其不良反应谱系呈现多···【详情】
推荐指数:12252025-08-28
色瑞替尼(Ceritinib)作为ALK阳性非小细胞肺癌的靶向治疗药物,其不良反应谱涉及多个···【详情】
推荐指数:12382025-08-28
塞瑞替尼(Ceritinib)作为ALK阳性非小细胞肺癌的靶向治疗药物,其副作用谱系涉及多个···【详情】
推荐指数:12472025-08-28
塞瑞替尼(Ceritinib)作为FDA批准的ALK阳性非小细胞肺癌靶向药物,其说明书详细规···【详情】
推荐指数:12342025-08-28
塞瑞替尼(Zykadia)作为治疗ALK阳性非小细胞肺癌的靶向药物,其储存条件直接影响药物稳···【详情】
推荐指数:12402025-08-28
色瑞替尼(Ceritinib)作为ALK阳性非小细胞肺癌的靶向治疗药物,其使用过程中需特别注···【详情】
推荐指数:12262025-08-28
本网站不销售任何药品,只做药品信息资讯展示 鲁ICP备2023035557号-5 证书编号:(鲁)-经营性-2022-0196 找药网 找药助手